


TRAILBLAZER-ALZ 2试验设计与结果摘要。图片来源:《美国医学会杂志》
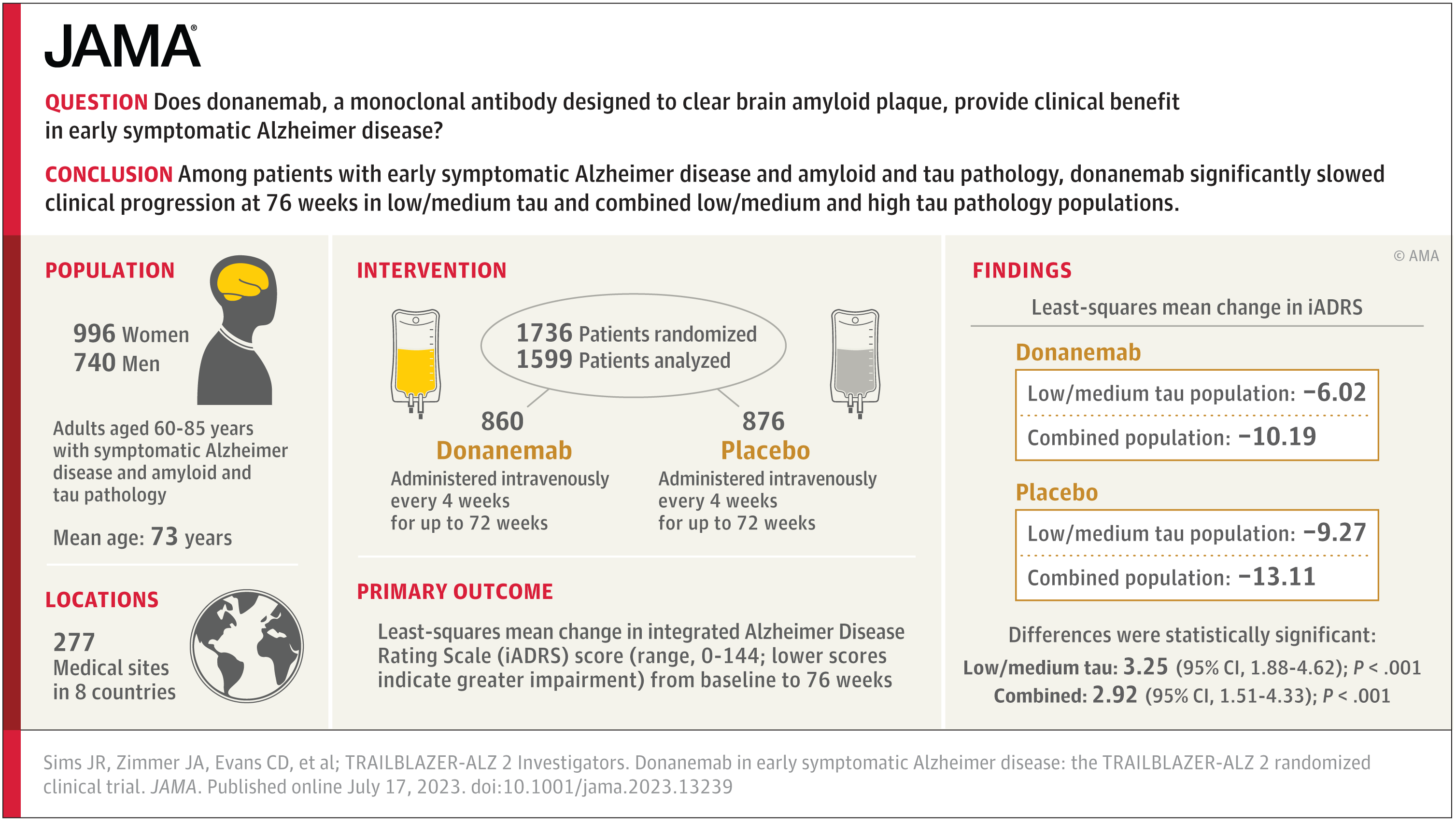
·Donanemab在18个月内将某些早期阿尔茨海默病患者的认知和功能下降速度减缓了35%。而Leqembi 的3期关键临床试验数据显示,它在18个月内使阿尔茨海默病患者的认知和功能下降速度减缓了27%。Leqembi每两周给药一次,Donanemab每四周给药一次。

TRAILBLAZER-ALZ 2试验设计与结果摘要。图片来源:《美国医学会杂志》
当地时间7月17日,美国礼来(LLY.US)公司宣布其已向美国食品药品监督管理局(FDA)提交了阿尔茨海默病新药Donanemab的上市申请,FDA预计2023年年底前做出决定。此外,礼来正在向其他全球监管机构提交文件,其中大部分将在年底前完成。
如果获得全面批准,Donanemab将成为继日本卫材药业(Eisai)和美国渤健公司(Biogen)联合开发的Leqembi(通用名:Lecanemab)之后的第二个“里程碑”。7月初,FDA完全批准Leqembi上市,为该药的适应症人群(阿尔茨海默病轻度认知障碍或轻度痴呆阶段的患者)打开了美国医疗保险的大门。
阿尔茨海默病是老年人中最常见的神经退行性疾病。从作用机制来看,Donanemab和Leqembi都通过清除β-淀粉样蛋白(Aβ)斑块起作用,这些斑块被认为是阿尔茨海默病的标志。如若获批,两种药物或将在阿尔茨海默病市场展开激烈对决。
礼来在本周末于荷兰举行的阿尔茨海默病协会国际会议(AAIC)上宣布了其向FDA提交文件的消息,同时展示了3期试验TRAILBLAZER-ALZ 2的完整数据,这些数据同时发表在《美国医学会杂志》(JAMA)上。
今年5月,礼来公司公布的顶线数据(topline data)显示,Donanemab在18个月内将某些早期阿尔茨海默病患者的认知和功能下降速度减缓了35%。而Leqembi 的3期关键临床试验数据显示,它在18个月内使阿尔茨海默病患者的认知和功能下降速度减缓了27%。Leqembi每两周给药一次,Donanemab每四周给药一次。
在礼来3期试验TRAILBLAZER-ALZ 2中,亚组分析结果表明,Donanemab对处于疾病早期阶段的试验参与者更有益,与安慰剂受试者相比,接受Donanemab治疗的受试者认知和功能的下降减缓了 60%,临床痴呆评定量表(CDR-SB)显示,患者认知能力衰退减缓了46%。
Donanemab的表现和参与者的年龄有关,在75岁以下的人群中,阿尔茨海默病综合评分量表(iADRS)显示临床衰退速度减缓了48%,CDR-SB减缓了45%;而对于75岁或以上的参与者,这两个数字分别为25%和29%。
Donanemab的副作用更为明显,3期试验中有3名患者出现了淀粉样蛋白相关成像异常 (ARIA),随后死亡,ARIA可能表现为脑肿胀、大脑内部或表面的小出血。此前,礼来公司已经证实其中2起死亡事件与ARIA有关,他们怀疑第3起也与此有关。
这3人中有2个人携带一个拷贝的APOE ε4遗传标记,该遗传标记与阿尔茨海默病早期风险增加相关。值得注意的是,研究人员指出,没有人被开具抗凝剂或抗血小板药物。Leqembi的临床数据显示,2名患者的死亡与使用抗凝剂或抗血小板药物相关。
总体而言,APOE ε4携带者患ARIA-E的风险增加,携带两个APOE ε4等位基因拷贝的人的患ARIA-E比率最高,为40.6%,拥有APOE ε4等位基因拷贝的人患有ARIA-E的比率为22.8%,非携带者中这一比率为15%。Leqembi的3期试验中没有与之相关的死亡事件。
13.1%的使用Donanemab的患者因不良事件(包括注射反应和ARIA-E)而停止治疗。虽然患者入组标准不同,且交叉试验比较远非完美,但相比之下,Leqembi的III期试验中有6.9%的人因不良事件而停止治疗。
Donanemab的3期临床试验在多样性上存在不足:该试验招募的有色人种患者很少,白人以外的种族和民族亚组的结果在统计学上并不显著。
“我们在这些群体中的人数非常少,置信区间非常广泛,”礼来神经科学研发副总裁Mark Mintun在新闻发布会上说。
在来自美国的1251名试验参与者中,只有两名是美洲印第安人或阿拉斯加原住民,11名是亚洲人,34名是黑人,71名是西班牙裔。
“这项Donanemab试验没有提供足够的证据证明美洲印第安人或阿拉斯加原住民,亚洲人,黑人或西班牙裔种族的安全性或有效性,”美国哥伦比亚大学(Columbia University)神经心理学教授Jennifer Manly和加州大学洛杉矶分校(UCLA)Kacie Deters教授在一篇社论中写道,“鉴于在这些群体中,许多人因阿尔茨海默病而产生的认知障碍和疾病负担不成比例,临床医生、患者和家庭了解已知疾病的局限性至关重要。”
Mintun说,在即将进行的一项安全性试验和一项针对有阿尔茨海默病风险的人的预防研究 中,礼来已经在患者招募中增加种族和民族多样性。
除此之外,该研究还将参与者的年龄限制在85岁,但医生指出,该药物可能用于比现实世界年龄大的成年人。
“撇开关于安全性和有效性的争论不谈,2023年淀粉样蛋白抗体将从严格控制的临床试验世界转移到现实世界,现在重要的是获取数据,无论(这些数据)多么不完美,并在不同的人群中实施。” 加州大学旧金山分校的Eric Widera及其同事在JAMA随附的社论中写道。
参考资料:https://endpts.com/eli-lilly-submits-donanemab-to-fda-as-it-shares-full-phiii-results-at-medical-meeting/





